Bestimmung der Wärmekapazität eines Kalorimeters
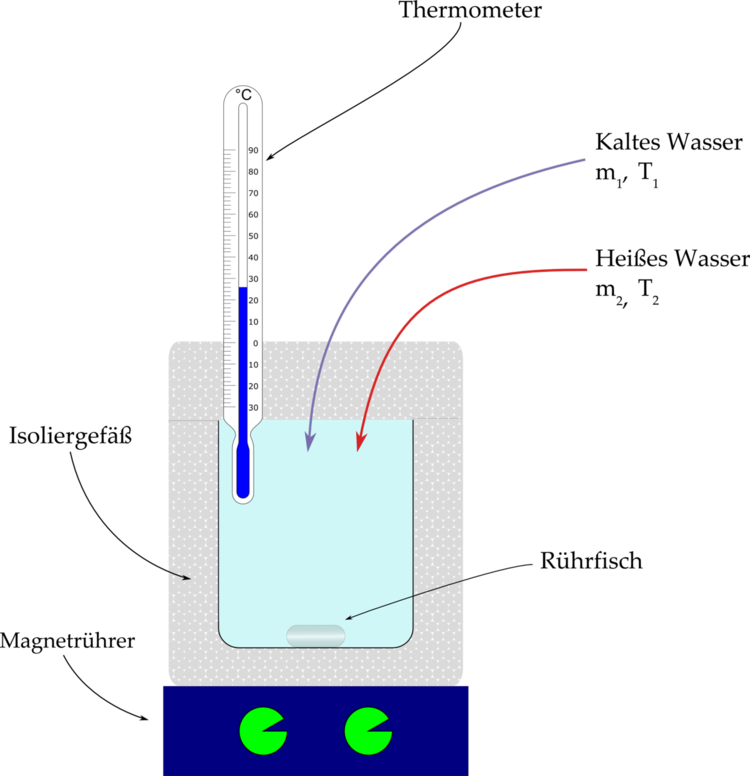
Material | Thermometer, Wasserkocher, Thermosgefäß/Kalorimetergefäß, Wasser, Waage, Magnetrührer, Rührfisch | |
Variante 1 | Variante 2 | |
Durchführung | ·Definierte Menge (20 mL) wird erhitzt. ·Messung der Temperatur des erhitzten Wassers ($T_W$) und des Kalorimetergefäßes ($T_G$) ·Erhitztes Wasser wird eingefüllt. ·Nach Einfüllen stellt sich die Temperatur $T_K$ ein. ·Berechnung der $C_{Kalorimeter}$ | ·Fügt man dem kalten Wasser warmes Wasser hinzu, findet ein Wärmeaustausch statt, bis eine Mischtemperatur erreicht wird. ·Kalorimetergefäß wird mit definierter Menge an kaltem Wasser gefüllt $(m_1$, $T_1), T$ wird gemessen. ·Wasser wird erhitzt und in definierter Menge zum kalten Wasser hinzugegeben $(m_2, T_2)$. ·Man wartet 5 min und misst die Mischungstemperatur $T_{misch}$. |
Beobachtung | Temperaturänderung | Mischvorgang, Wärmeaustausch |
Auswertung | Die Wärmekapazität kann über folgende Formel berechnet werden: $C_{Kalorimeter}=C_W=c_W \cdot m$ $C_{gesamt}= C_{Wasser}+ C_{Kalorimeter}$ | Nach dem Energieerhaltungssatz entspricht die vom warmen Wasser abgegebene Wärme der des kalten Wassers und der vom Kalorimetergefäß aufgenommenen Wärme. $Q_{kalt} + Q_{Kalorimeter} = Q_{warm}$ wird nach $C_{Kalorimeter}$aufgelöst: $(m_1 \cdot c_W+ C_{Kalorimeter}) \cdot (T_{misch} - T_1) = (m_2 \cdot c_W) \cdot (T_2 - T_{misch})$ |
| $\Downarrow$ | ||
$\LARGE{c_{Kalorimeter} = \frac{m_2~ \cdot ~c_W~ \cdot ~(T_2 ~ -~ T_{misch})~+~m_1~ \cdot ~c_W~ \cdot ~(T_1 ~- ~T_{misch})}{T_{misch}~ - ~T_1}}$
Weitere interessante Inhalte zum Thema
-
Ethogramm
Vielleicht ist für Sie auch das Thema Ethogramm (Ethologische Aspekte des Verhaltens) aus unserem Online-Kurs Verhalten interessant.





 zum Kurs
zum Kurs 




